■Top Pageへ
 Topへ Topへ
■ 再生医療とは何か
生体は元来、「生体恒常性」という能力をもっている。
つまり外的および内的環境の変化を受けても、生理状態などを常に一定範囲内に調整し、
恒常性を保つ能力がある。
これらは神経やホルモンの働きによるとも言われ、恒常性の保たれる範囲は、体温や血圧、体液の浸透圧や
pHをはじめ、病原微生物やウイルスといった異物(非自己)の排除、創傷の修復など生体機能全般に及び、
これをホメオスターシスという。
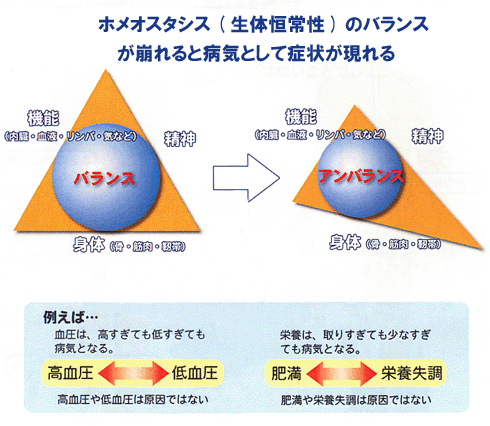
病気とは、この「生体恒常性」が外的または内的要因で、自己修復力の限界を超えた状況といえる。
だから病気の治療とは、医者や薬が病そのものを治療するものではなく、
患者が本来持っている「自己修復力」を、それを疎外している要因を排除し、
自己修復力を活性化させる行為といえる。
近年「再生医療」が脚光をあび、一部は部臨床段階まで実用化に近づているものもある。
この「再生医療」の考え方の基本は、自己修復力を上手く引き出して利用し医療に役立てるという考え方である。
この考え方自体は新しい概念ではなく、東洋医学などてすでにさまざまな形で行われてきた。
つまり近年の「再生医療」とは、従来の医療では治療できない病気を治すため
“自己修復力の新しい引き出し方を、「細胞レベルで開発」し、「細胞移植治療」を行う”
これが現在の再生医療の考え方であり、再生医療の研究課題であるる。
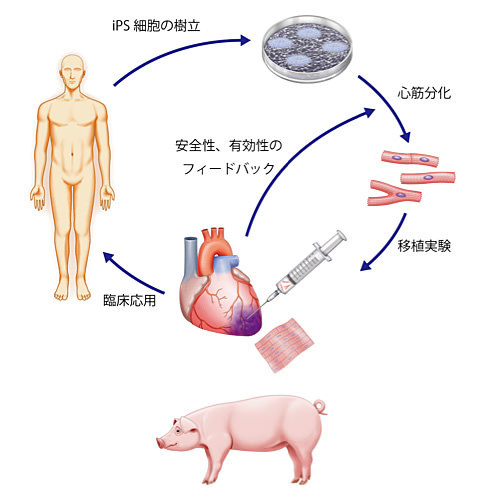
外的または内的要因で、失われた生体器官の自己修復力を、
多能性幹細胞移植によって回復させようという新しい治療法である。
こうした革新的な多能性細胞の移植で、失われた生体器官の自己修復力を進めようというのが、近年いはれる
「再生医療」として脚光をあびているのである。
paeTOP
■iPS細胞とES細胞の違い
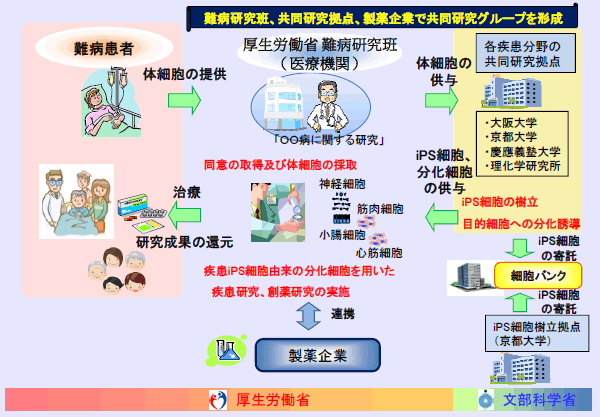
再生医療として脚光を浴びている「細胞移植治療」(いわゆる再生医療)に関して、
iPS細胞とES細胞が、細胞移植治療に用いるレベルに近づいている。
細胞移植治療で最大の課題は、
①移植後に移植した細胞の異常が起きないことと
②移植した細胞や移植先の細胞で拒絶反応が起きないこと、などがある。
① 移植後に移植した細胞の異常が起きないこと
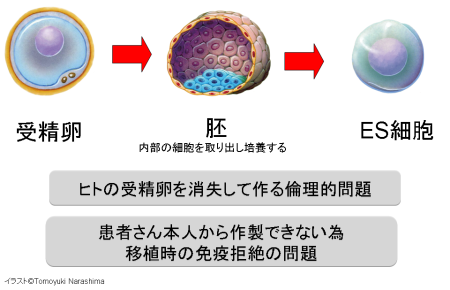
ES細胞は、発生初期の受精卵の細胞から作った細胞であるため、遺伝子への操作などはなく、
細胞へのストレスは少ないと考 えられ、腫瘍形成のリスクは低いとされている。
一方、iPS細胞は、一度成長したヒトの細胞に、人工的な操作を加えて作った細胞であるため、
この操作過程で遺伝子の変異 が起こっていることが考えられる。
この遺伝子の変異が悪いものであった場合、移植した細胞が腫瘍を形成する可能性がある。
そのリスクを低減させるため、 iPS細胞研究所では、作製したiPS細胞を詳しく遺伝子解析し、
どのような遺伝子変異が起きているかを確認し、ヒトへの投与に 問題ないiPS細胞を選んでいる。
② 移植した細胞や移植先の細胞で拒絶反応が起きないこと。
ES細胞を作製するために受精卵を用いるが、細胞の型(HLA型)は、その受精卵に由来するため、
細胞移植治療の際、患者 と同じ細胞の型(HLA型)でない場合は、拒絶反応を起こす可能性がある。
またES細胞の作製には、生命の萌芽である受精卵を材料として用いるため、倫理的な問題がある。このため社会
インフラとして機能する「細胞バンク」のに必要なES細胞を作製するための
受精卵の確保は大変難しい状況である。
iPS細胞は、自家移植(本人の細胞から作製したiPS細胞を移植)が可能であり、
自分自身から作製したiPS細胞から、目的の移植する細胞を作製できれば、
拒絶反応の少ない細胞移植治療が提供されると期待されている。
また、他家移植(他人の細胞から作製したiPS細胞を移植)でも、
予め拒絶反応のおこしにくい細胞の型を有するヒト(HLAホモ ドナー)からiPS細胞を作製し、
それを保管する細胞ストックを作っておけば、約数か月から場合によっては半年という作製期間が短縮でき、
治療が必要な際にすぐに使用できることが期待されている。
■ iPS細胞の名の由来
iPS細胞の正式名称は、英語で "induced pluripotent stem cell"という。
この頭文字を組み合わせた名前がiPS細胞(cell=細胞)である。
inducedというのは「人工的に誘導した」という意味で、
複数の遺伝子を人工的に導入して作製したことに由来する。
Pluripotentのpluriは複数(plural)を表す接頭辞、
potentは能力があるという意味で、pluripotentは多能性と訳される。
つまり「受精卵のように、体中のあらゆる細胞になれる能力を持つ」という、生物学の用語である。
stem cellの訳は「幹細胞」である。
幹細胞とは、細胞分裂を繰り返して、同じ細胞を増やせる能力(自己複製能) と、
複数の異なる細胞に分化(変化)できる能力(多分化能)を併せ持った細胞のこと。
従って、iPS細胞とは、人工的に誘導した多能性幹細胞の事で、日本語では「人工多能性幹細胞」と呼ぶ。
様々な細胞に変化できる能力を持つことから、「万能細胞」と呼ばれることもある。
このiPS細胞の作製に世界で初めて成功したのが京都大学の山中伸弥教授で、
2012年にノーベル医学・生理学賞を受賞された。
paeTOP
■iPS細胞の発見
受精卵は、生物種の精子と卵子が結合して形成する最初の細胞である。
この受精卵は、子宮内で細胞分裂を行って「胚」となり、細胞分裂することで生物の個体が発生していくため、生
命の萌芽であると考えられている。
胚(Embryo)とは、多細胞生物の個体発生におけるごく初期の段階の個体を指す。
この胚が分裂を繰り返して、様々な生体の器官へ成長する。
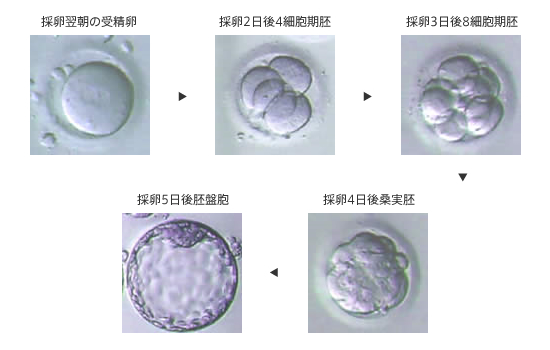
ES細胞は、この発生初期の受精卵の細胞から作った細胞であるため、
細胞移植に本格的に応用するには、倫理的な問題がある。
卵子を用いなくても、体細胞を受精卵と同じような多能性幹細胞に「初期化」できるこを示した
iPS細胞の作製は画期的な成果だった。
未分化細胞のES細胞は、未分化状態を示す多能性を維持している。
iPS細胞の発見者の山中教授は、ES細胞の「多能性」の維持に関与する遺伝子を探す課程で、
「多能性維持」に 重要な遺伝子が、「分化細胞を未分化の細胞に初期化する」のに必要な遺伝子と同じ、
という仮説を立てた。
最終的に4つの遺伝子
「Oct3/4(オクトスリーフォー)」、
「Sox2(ソックスツー)」、
「Klf4(ケーエルエフフォー)」、
「c-Myc(シーミック)」が、
初期化を誘導するのに重要な働きをしていることが明らかにされた。
こうして、これらの遺伝子はヤマナカファクター(山中因子)とも呼ばれている。
■iPS細胞とは
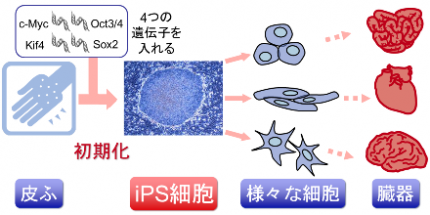
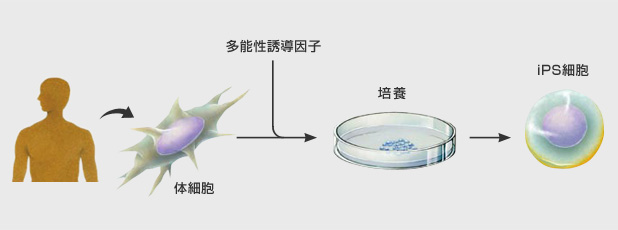
人間の皮膚などの体細胞に、4つの遺伝子を導入し培養することによって、
様々な組織や臓器の細胞に分化する能力と、ほぼ無限に増殖する能力をもつ多能性幹細胞ができる。
この細胞を人工多能性幹細胞 (induced pluripotent stem cell:iPS細胞)と呼ぶ。
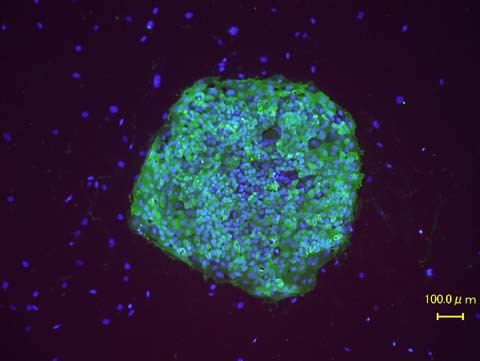
初期化された細胞
iPS細胞は、ヒトの皮膚などの細胞に遺伝子を入れ、人工的に作った細胞で、人間の子宮の中で、
まだ細胞に分化していない状態の細胞(幹細胞)と同じような能力を備えている。
このため研究は、このiPS細胞を使って子宮内で起こっていることと同じようなことを試験管の中で起こし
ヒトの細胞や組織、臓器などを作り出そうとしている。
そうしてできた細胞や臓器を、身体に移植して治療すれば、傷んだ部分を修復できる可能性が高い。
iPS細胞は、「万能細胞」と称されるように、ヒトのあらゆる細胞になり得る。
臓器が作れれば、臓器提供者不足も克服でき、今まで治療困難だった病気の新薬開発にも応用できる。
この故に革新的な再生医療として注目を受けている。
paeTOP
■iPS細胞の作製方法
世界中の大勢の研究者が様々なiPS細胞の作製方法を開発している。
例えば、山中教授のグループと同時期にヒトiPS細胞の作製に成功したトムソン教授は
Oct3/4, Sox2, Nanog, Lin28の4遺伝子を使いました。
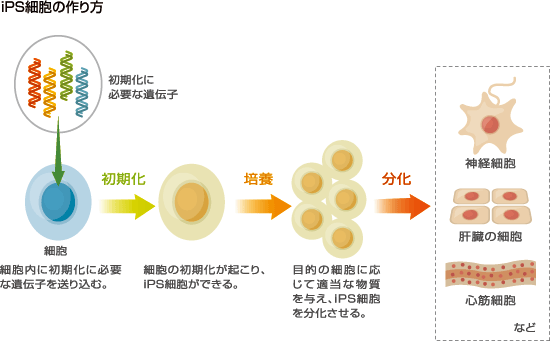
また、レトロウイルスベクターの代わりに、
レンチウイルスやアデノウイルスをベクターとして用いてiPS細胞を樹立した研究者や、
遺伝子を用いず、化合物を用いて、iPS細胞を作製したという報告もあります。

CiRA(京都大学 iPS細胞研究所)では、その後さまざまな樹立法の研究を進めた結果、
当初の樹立法からより安全性の高い方法を確立することに成功しており、
例えばがん化の危険性を高めると考えられたc-Myc遺伝子をL-Mycに変更する、
また、細胞が持つ もともとのゲノム情報を傷つけ、がん化を引き起こすとされたウイルスベクターを用いずに、
エピソーマル・プラスミドを使ってヒトiPS細胞を樹立することにも成功しています。
■iPS細胞は、どんな年齢の人の体細胞からも作製できるか?.
山中教授のグループでは、6歳から81歳まで、様々な年齢の日本人の皮膚細胞から
iPS細胞の作製に成功しています。それらのiPS細胞の多能性に大きな違いはありません。
■iPS細胞を利用した新しい薬の開発(創薬)や医療への応用
iPS細胞研究は、標準的なiPS細胞の基準作り、安全なiPS細胞の作製方法の確立、
動物を用いた治療効果と安全性の確認など、iPS細胞が発表された2006年と比較すると
大きく研究が進展し、2013年には人間での安全性を確かめる研究も開始されました。
政府によるiPS細胞の臨床、医療応用の指針の策定など、克服するべき課題もありますが、
国内外の研究者たちは、一日でも早く多くの患者の元へ
iPS細胞を利用した新しい医療が届けられるように研究を続けています。
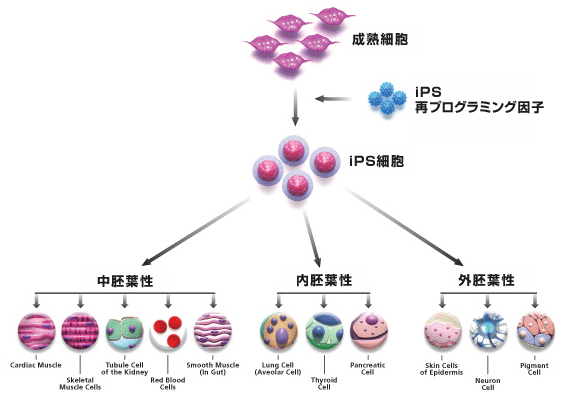
■iPS細胞からどんな組織や臓器の細胞を作ることができるのか?
現在の国内外の研究成果を調べると、
iPS細胞から、神経、心筋、血液など、
様々な組織や臓器を構成する細胞に分化することが報告されています。
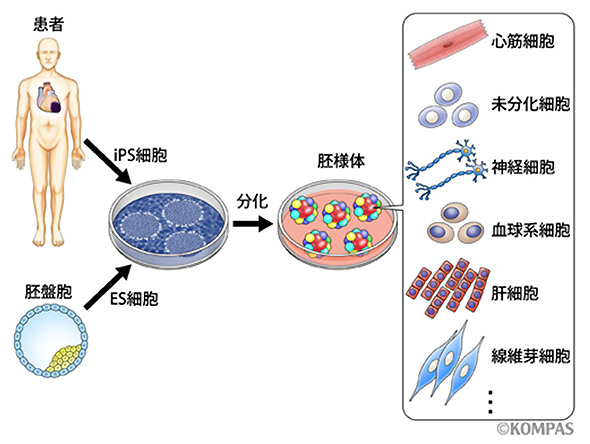
ただし、細胞や組織というものは、臓器という立体的なものの一部にすぎません。
そのため、立体的な臓器をつくる試みもなされており、
小さな肝臓などを作ったという報告(Nature. 2013 July 25; 499: 481-484)もありますが、
人間のサイズに見合う、あるいは人間の体内で機能するような
大きく立体的な臓器ができたという報告はまだありません。
今後、3Dプリンターやバイオマテリアルなど、さまざまな素材や技術と組み合わせ、
発展が期待されている分野といえるでしょう。
paeTOP
■iPS細胞技術が確立すれば、どんな病気やケガでも治療可能になるのか?.
理論上、身体を構成する細胞であれば、iPS細胞はどのような細胞へも分化できますが、
それが何にでも応用可能であるとは限りません。
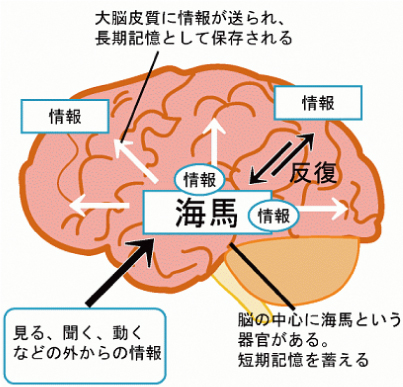
例えば、記憶を司る脳が損なわれてしまう場合などは、
神経科学の分野においても、記憶の形成などはいまだ大きな謎の一つであります。
また、細胞を用いることなく、新規の薬剤や治療機器の登場を待つほうがよい場合もあると考えられます。
したがって、他の研究分野の発展とも並行し連携しながら、どのような疾患の治療にiPS細胞技術が有効である
かを検討する必要があります。
■iPS細胞は免疫拒絶を起こすのか?.
2011年5月にマウスから作ったiPS細胞を、遺伝的に全く同じと言えるマウスにiPS細胞を移植した結果、
胚性幹(ES)細胞よりも、免疫反応が引き起こされやすい可能性があることが報告され、
各メディアでも取り上げられました。(Zhao et al. Nature. 2011 May 13;474(7350): 212-215.)
これまでiPS細胞を移植した時に、どのような反応が起きるのかについて、
きちんと解析されていなかった状況の中での重要な報告ではありますが、
CiRAではさらに詳細な検証が必要と考え、米国雑誌で見解を発表しました。(Okita et al.Circulation Research
2011 Sep16;109(7):720-721.)
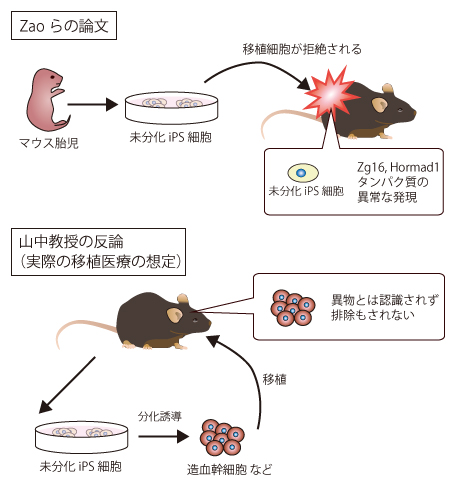
Zhaoらの論文では、未分化なiPS細胞を移植していますが、
実はこれは医療応用の現実とかけ離れたものです。
未分化なiPS細胞を移植すると、奇形腫をつくってしまうので、
医療の現場で用いる場合には、しっかりと目的の細胞に分化させ、
未分化な細胞を取り除いてから、移植することが必要です。
私たちの体内で、腫瘍が形成される時、免疫系が反応し、これを排除しようとする現象があります。
ですから、いくら自己の細胞から作製したiPS細胞であっても、未分化なまま移植して奇形腫を作らせたら、
Zhaoらの論文のように、これを排除しようとする免疫反応が起きても不思議ではありません。
2013年にはCiRAの高橋淳教授らのグループが、サルを使った研究で
iPS細胞から作製した、神経細胞を脳内に移植する実験を行い、
自己の細胞から作製した細胞の場合は、殆ど免疫反応が起こらないことを報告しています。
このように実際に行われる移植方法に則した形で、免疫反応の有無等を検証する必要があります。
paeTOP
■iPS細胞の課題
■iPS細胞の安全性に関する課題
病気や怪我で失われた細胞を、iPS細胞から作製して移植する、
細胞移植治療の実現を目指した研究が国内外で行われています。
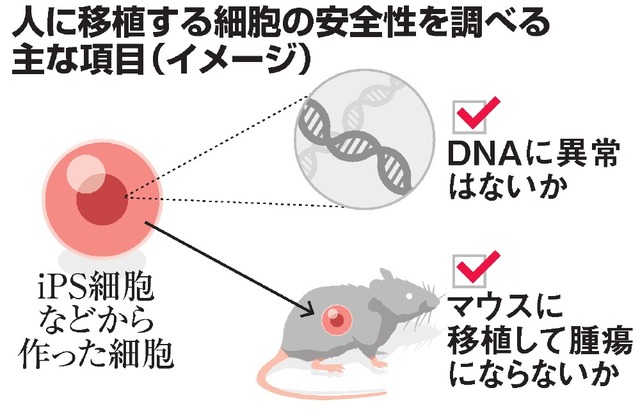
iPS細胞を用いた再生医療における安全性の課題として、
腫瘍が形成されるのではないか、という懸念がありました。
これまで、世界中でiPS細胞の安全性の向上に関する研究が行われてきました。
とりわけ、CiRAでは研究所をあげてこの課題に取り組んできました。その結果、懸念された課題を解決し、大幅に
安全性を高めることに成功しています。
iPS細胞が腫瘍化するメカニズムは、大きく分けて2つの理由が考えられてきました。
1つは細胞に導入された初期化因子が再活性化すること、
あるいは人工的に初期化因子を導入するため、
もともとの細胞がもつゲノムに傷がつくことで、iPS細胞が腫瘍化してしまう、というものです。
これについては、再活性化を起こさない最適な初期化因子が探索され、また、
初期化因子が細胞の染色体に取り込まれない(ゲノムに傷をつけない)iPS細胞の作製方法が開発されています。
もう1つは、
未分化細胞(目的の細胞に変化しきれていない細胞)が残存すること等によって引き起こされる、
テラトーマと呼ばれる奇形腫(良性腫瘍)の形成です。
これについては、iPS細胞の増殖や分化に関する研究を進めており、着実に成果をあげつつあります。
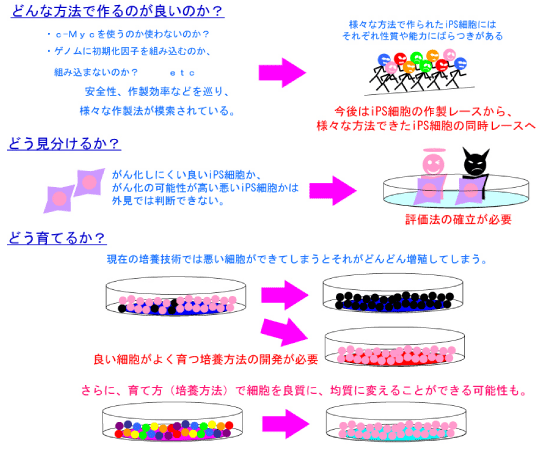
■1.最適な初期化因子の探索
山中伸弥教授らが、2006年に発表した論文で
マウスiPS細胞を作製するときに用いた初期化因子の一つ、c-Mycは、がん原遺伝子として知られています。
この遺伝子が細胞内で活性化し、腫瘍が引き起こされる可能性が指摘されてきました。
しかし、中川誠人講師らは2010年に、c-Mycの代替因子としてL-Mycが有望であることを報告しました。
L-Mycを用いて作製したiPS細胞は、腫瘍形成がほとんど無くかつ作製効率や多能性も高いことを示している。
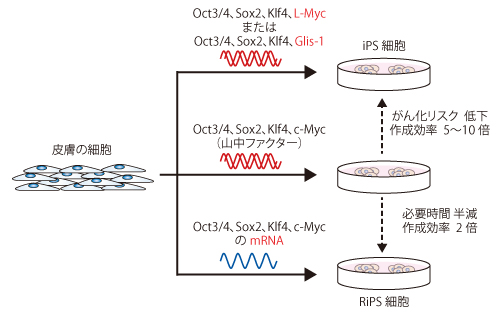
■2.最適なベクターの探索
iPS細胞の作製に必要な初期化因子を、皮膚細胞などの体の細胞に導入するとき、
当初は、レトロウイルスやレンチウイルスをベクター(運び屋)とする方法が使われました。
これは、目的の遺伝子をウイルスの中に取り入れ、そのウイルスを細胞に感染させて、
目的の遺伝子を細胞の中に導入するというものでした。
レトロウイルスやレンチウイルスをベクターとして用いると、
ウイルスが細胞のゲノムDNAにランダムに組み込まれてしまい、
その細胞にもともとある遺伝子が失われたり、あるいは逆に活性化されたりする可能性があり、
その結果、細胞が腫瘍化する危険性がありました。
しかし、沖田圭介講師らは、2008年にプラスミドと呼ばれる、
細胞の染色体に取りこまれることのない環状DNA(プラスミド)をベクターとして用いることで、
初期化因子が、細胞の染色体に取り込まれないiPS細胞の作製方法を開発しました。
さらに、沖田講師らは、2011年に、OCT3/4, SOX2, KLF4, LIN28, L-MYC, p53shRNAという6つの因子を、
自律的に複製するエピソーマル・プラスミドを用いて導入することで、作製効率を高めることに成功しました。
■3.安全な細胞を樹立・選別する方法の確立
上記のように、適切な遺伝子や遺伝子導入法を用いて樹立したiPS細胞を、目的の体の細胞に分化させた場合、
分化した後の細胞が、再びiPS細胞に戻ることはありません。
しかし、目的の細胞に分化しきれていない、未分化な細胞が少しでも残っていた場合、
その細胞が腫瘍になってしまうことが考えられます。
これまで、iPS細胞は、同じ人から同じ方法で作った場合でも、細胞株によって、
増殖や分化する能力にばらつきが見られることがわかっていました。
つまり、分化能力が低いiPS細胞を用いると、細胞の集団の中に分化しきれていない細胞が残ってしまい、
奇形腫を形成してしまう危険があったのです。
しかし、2013年に、高橋和利講師や青井三千代研究員(現、神戸大学助教)らは、
神経細胞への分化能力の高いiPS細胞株を、簡単に選別する方法を開発しました。
また、iPS細胞樹立時や、その後の培養時に発生するゲノム等の傷が、腫瘍の原因となる可能性もあります。
渡辺亮助教らは、iPS細胞に存在するゲノム等の傷を鋭敏に検知する方法を開発しています。
■4.目的の細胞に確実に分化させる方法の開発
細胞移植治療を行う場合、iPS細胞をそのまま人体に移植するのではなく、
目的の体の細胞に分化させた細胞を移植します。
したがって、iPS細胞から、目的の細胞に確実に分化させる方法を開発することが重要と考え
CiRAでは様々な細胞への分化技術の開発に取り組んでいます。
髙橋淳教授らは、iPS細胞からドパミン産生神経細胞を効率良く分化させる方法を開発しています。
また、江藤浩之教授らは、2014年にiPS細胞から、血小板を大量かつ安定的に産生する方法を報告しました。
これらの成果は、パーキンソン病のような神経疾患、再生不良性貧血など、
血液疾患に対するiPS細胞を使った再生医療に向けた大きな一歩です。
paeTOP
■安全性の課題の克服はいつ頃か?
PS細胞を初めて報告してからの約8年間の研究により、樹立方法は大きく進歩し、
また品質の評価方法も確立されつつあります。
■iPS細胞を用いた細胞移植治療はいつ実現するか?.

実際、iPS細胞由来の網膜色素上皮細胞を、加齢黄班変性の患者さんに移植する再生医療について、
動物実験による安全性の検証を経て、2013年に臨床研究を開始することが厚生労働省により承認されました。
2014年には、少数の患者さんの体の細胞から作ったiPS細胞由来網膜色素上皮細胞が、
その患者さんに移植される予定で、安全性の最終確認が行われます。
また、脊髄損傷、パーキンソン病(ニュースリリース2013.09.27、ニュースリリース2012.01.24)、心不全、
再生不良性貧血などの血液疾患に関しては、
iPS細胞を使った再生医療の安全性が動物実験で検証されています。
■iPS細胞由来の患部細胞を使用し、新薬や治療法の実現にどのような課題があるか?.
患者さん由来のiPS細胞から作製された細胞を用いる研究は、
動物細胞を用いる場合などと比較して、ヒトの病気のメカニズムをさらに忠実に反映したモデルと考えられます。
つまり、これまでより詳細に「なぜ病気がおこるのか?」という仕組みを知ることができ、
病気の進行を止めたり、遅らせたり、あるいは治癒する薬剤の探索への応用が期待されています。
また、さまざまな遺伝的背景を持つiPS細胞を樹立することで、
心臓や肝臓など、薬の副作用が出やすい臓器の細胞を作製して、薬のもととなる化合物を投与し、
本来の機能が失われないか(副作用が出ないか)調べることも出来ます。
こうした研究は、細胞移植という治療法に加え、より多くの患者さんへと治療法を提供することにつながるため、
今後は、より強力に進めることが望まれます。
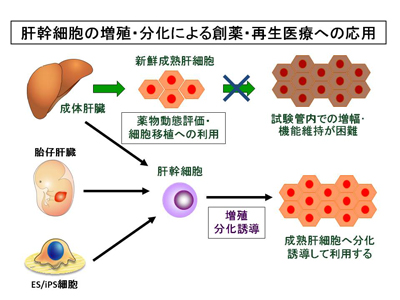
ただし、細胞レベルで認められる異常が、実際の患者さんの病気の本当の原因であるかは、
実際の患者さんの病態を再現しつつ、注意深く解析する必要があります。
また、iPS細胞を使って見つかった薬剤が、患者さんにどのくらい有効であるか、
また十分な安全性があるかについて、幅広く確認していく必要もあります。
このため、創薬研究やその実用化は、CiRAだけでなくオールジャパンでの取り組みが不可欠です。
paeTOP
■Top Pageへ
|
|